§ 15-ж. Закон радиоактивного распада
Появление «ручных» сцинтилляционных счетчиков и, главным образом, счётчиков Гейгера–Мюллера, которые помогли автоматизировать подсчёты частиц (см. § 15-е), привело физиков к важному выводу. Любой радиоактивный изотоп характеризуется самопроизвольным ослабеванием радиоактивности, выражающимся в уменьшении количества распадающихся ядер в единицу времени.
Построение графиков активности различных радиоактивных изотопов приводило учёных к одной и той же зависимости, выражающейся показательной функцией (см. график). По горизонтальной оси отложено время наблюдения, а по вертикальной – количество нераспавшихся ядер. Кривизна линий могла быть различной, однако сама функция, которой выражались описываемые графиками зависимости, оставалась одной и той же:
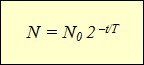
Эта формула выражает закон радиоактивного распада: количество нераспавшихся с течением времени ядер определяется как произведение начального количества ядер на 2 в степени, равной отношению времени наблюдения к периоду полураспада, взятой с отрицательным знаком.
Как выяснилось в ходе опытов, различные радиоактивные вещества можно охарактеризовать различным периодом полураспада – временем, за которое количество ещё нераспавшихся ядер уменьшается вдвое (см. таблицу).
Периоды полураспада некоторых изотопов некоторых химических элементов. Приведены значения как для естественных, так и для искусственных изотопов.
| Йод-129 | 15 млн лет | Углерод-14 | 5,7 тыс лет | |
| Йод-131 | 8 дней | Уран-235 | 0,7 млрд лет | |
| Йод-135 | 7 часов | Уран-238 | 4,5 млрд лет |
Период полураспада – общепринятая физическая величина, характеризующая скорость радиоактивного распада. Многочисленные опыты показывают, что даже при очень длительном наблюдении за радиоактивным веществом его период полураспада постоянен, то есть не зависит от числа уже распавшихся атомов. Поэтому закон радиоактивного распада нашёл применение в методе определения возраста археологических и геологических находок.
Метод радиоуглеродного анализа. Углерод – очень распространённый на Земле химический элемент, в состав которого входят стабильные изотопы углерод-12, углерод-13 и радиоактивный изотоп углерод-14, период полураспада которого составляет 5,7 тысяч лет (см. таблицу). Живые организмы, потребляя пищу, накапливают в своих тканях все три изотопа. После прекращения жизни организма поступление углерода прекращается, и с течением времени его содержание убывает естественным путём, за счёт радиоактивного распада. Поскольку распадается только углерод-14, с течением веков и тысячелетий изменяется соотношение изотопов углерода в ископаемых останках живых организмов. Измерив эту «углеродную пропорцию», можно судить о возрасте археологической находки.
Метод радиоуглеродного анализа применим и для геологических пород, а также для ископаемых предметов быта человека, но при условии, что соотношение изотопов в образце не было нарушено за время его существования, например, пожаром или действием сильного источника радиации. Неучёт подобных причин сразу после открытия этого метода приводил к ошибкам на несколько веков и тысячелетий. Сегодня применяются «вековые калибровочные шкалы» для изотопа углерода-14, исходя из его распределения в долгоживущих деревьях (например, в американской тысячелетней секвойе). Их возраст можно подсчитать весьма точно – по годовым кольцам древесины.
Предел применения метода радиоуглеродного анализа в начале XXI века составлял 60 000 лет. Для измерения возраста более древних образцов, например горных пород или метеоритов, используют аналогичный метод, но вместо углерода наблюдают за изотопами урана или других элементов в зависимости от происхождения исследуемого образца.
В вашем браузере отключен Javascript.Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
Законы радиоактивного распада ядер
Способность ядер самопроизвольно распадаться, испуская частицы, называется радиоактивностью. Радиоактивный распад - статистический процесс. Каждое радиоактивное ядро может распасться в любой момент и закономерность наблюдается только в среднем, в случае распада достаточно большого количества ядер.
Постоянная распада
λ - вероятность распада ядра в единицу времени.
Если в образце в момент времени t имеется Nрадиоактивных ядер, то количество ядер dN, распавшихся за время dt пропорционально N.
dN = -λNdt. (13.1)
Проинтегрировав (1) получим закон радиоактивного распада
N(t) = N 0 e -λt . (13.2)
N 0 - количество радиоактивных ядер в момент времени t = 0.
Cреднее время жизни
τ –
. (13.3)
Период полураспада T 1/2 - время, за которое первоначальное количество радиоактивных ядер уменьшится в два раза
T 1/2 = ln2/λ=0.693/λ = τln2. (13.4)
Активность A - среднее количество ядер распадающихся в единицу времени
A(t) = λN(t). (13.5)
Активность измеряется в кюри (Ки) и беккерелях (Бк)
1 Ки = 3.7*10 10 распадов/c, 1 Бк = 1 распад/c.
Распад исходного ядра 1 в ядро 2, с последующим его распадом в ядро 3, описывается системой дифференциальных уравнений
 (13.6)
(13.6)
гдеN 1 (t) и N 2 (t) -количество ядер, а λ 1 иλ 2 - постоянные распада ядер 1 и 2 соответственно. Решением системы (6) с начальными условиями N 1 (0) = N 10 ; N 2 (0) = 0 будет
![]() , (13.7a)
, (13.7a)
![]() . (13.7б)
. (13.7б)

| Рисунок 13. 1 |
Количество ядер 2 достигает максимального значения
Если λ 2 < λ 1 (), суммарная активностьN 1 (t)λ 1 + N 2 (t)λ 2 будет монотонно уменьшаться.
Если λ 2 >λ 1 ()), суммарная активность вначале растет за счет накопления ядер 2.
Если λ 2 >> λ 1 , при достаточно больших временах вклад второй экспоненты в (7б) становится пренебрежимо мал, по сравнению со вкладом первой и активности второго A 2 = λ 2 N 2 и первого изотопов A 1 = λ 1 N 1 практически сравняются. В дальнейшем активности как первого так и второго изотопов будут изменяться во времени одинаково.
A 1 (t) = N 10 λ 1 = N 1 (t)λ 1 = A 2 (t) = N 2 (t)λ 2 . (13.8)
То есть устанавливается так называемое вековое равновесие , при котором число ядер изотопов в цепочке распадов связано с постоянными распада (периодами полураспада) простым соотношением.
 . (13.9)
. (13.9)
Поэтому в естественном состоянии все изотопы, генетически связанные в радиоактивных рядах, обычно находятся в определенных количественных соотношениях, зависящих от их периодов полураспада.
В общем случае, когда имеется цепочка распадов 1→2→...n, процесс описывается системой дифференциальных уравнений
dN i /dt = -λ i N i +λ i-1 N i-1 . (13.10)
Решением системы (10) для активностей с начальными условиями N 1 (0) = N 10 ; N i (0) = 0 будет
![]() (13.12)
(13.12)
Штрих означает, что в произведении, которое находится в знаменателе, опускается множитель с i = m.
Изотопы
ИЗОТОПЫ –разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов (см .также АТОМА ЯДРО). Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопаминазываются поэтомуразновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и созданапротонно-нейтронная модель ядра.В результатев науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение A X.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка. В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И. Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада:радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей) , выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом(илимасс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов. Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235 U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов. Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D 2 O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтез. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим данным, проводится более 36 тыс. медицинских процедур в день и около 100 млн. лабораторных тестов с использованием изотопов. Наиболее распространены процедуры, связанные с компьютерной томографией. Изотоп углерода C 13 , обогащенный до 99% (природное содержание около 1%), активно используется в так называемом «диагностическом контроле дыхания». Суть теста очень проста. Обогащенный изотоп вводится в пищу пациента и после участия в процессе обмена веществ в различных органах тела выделяется в виде выдыхаемого пациентом углекислого газа СО 2 , который собирается и анализируется с помощью спектрометра. Различие в скоростях процессов, связанных с выделением различных количеств углекислого газа, помеченных изотопом С 13 , позволяют судить о состоянии различных органов пациента. В США число пациентов, которые будут проходить этот тест, оценивается в 5 млн. человек в год. Сейчас для производства высоко обогащенного изотопа С 13 в промышленных масштабах используются лазерные методы разделения.
Похожая информация.
1. Радиоактивность. Основной закон радиоактивного распада. Активность.
2. Основные виды радиоактивного распада.
3. Количественные характеристики взаимодействия ионизирующего излучения с веществом.
4. Естественная и искусственная радиоактивность. Радиоактивные ряды.
5. Использование радионуклидов в медицине.
6. Ускорители заряженных частиц и их использование в медицине.
7. Биофизические основы действия ионизирующего излучения.
8. Основные понятия и формулы.
9. Задачи.
Интерес медиков к естественной и искусственной радиоактивности обусловлен следующим.
Во-первых, все живое постоянно подвергается действию естественного радиационного фона, который составляют космическая радиация, излучение радиоактивных элементов, залегающих в поверхностных слоях земной коры, и излучение элементов, попадающих в организм животных вместе с воздухом и пищей.
Во-вторых, радиоактивное излучение применяется в самой медицине в диагностических и терапевтических целях.
33.1. Радиоактивность. Основной закон радиоактивного распада. Активность
Явление радиоактивности было открыто в 1896 г. А. Беккерелем, который наблюдал спонтанное испускание солями урана неизвестного излучения. Вскоре Э. Резерфорд и супруги Кюри установили, что при радиоактивном распаде испускаются ядра Не (α-частицы), электроны (β-частицы) и жесткое электромагнитное излучение (γ-лучи).
В 1934 г. был открыт распад с вылетом позитронов (β + -распад), а в 1940 г. был открыт новый тип радиоактивности - спонтанное деление ядер: делящееся ядро разваливается на два осколка сравнимой массы с одновременным испусканием нейтронов и γ -квантов. Протонная радиоактивность ядер наблюдалась в 1982 г.
Радиоактивность - способность некоторых атомных ядер самопроизвольно (спонтанно) превращаться в другие ядра с испусканием частиц.
Атомные ядра состоят из протонов и нейтронов, которые имеют обобщающее название - нуклоны. Количество протонов в ядре определяет химические свойства атома и обозначается Z (это порядковый номер химического элемента). Количество нуклонов в ядре называют массовым числом и обозначают А. Ядра с одинаковым порядковым номером и различными массовыми числами называются изотопами. Все изотопы одного химического элемента имеют одинаковые химические свойства. Физические свойства изотопов могут различаться весьма сильно. Для обозначения изотопов используют символ химического элемента с двумя индексами: A Z Х. Нижний индекс - порядковый номер, верхний - массовое число. Часто нижний индекс опускают, так как на него указывает сам символ элемента. Например, пишут 14 С вместо 14 6 С.
Способность ядра к распаду зависит от его состава. У одного и того же элемента могут быть и стабильный, и радиоактивный изотопы. Например, изотоп углерода 12 С стабилен, а изотоп 14 С радиоактивен.
Радиоактивный распад - явление статистическое. Способность изотопа к распаду характеризует постоянная распада λ.
Постоянная распада - вероятность того, что ядро данного изотопа распадется за единицу времени.
Вероятность распада ядра за малое время dt находится по формуле
Учитывая формулу (33.1), получим выражение, определяющее количество распавшихся ядер:
 Формула (33.3) называется основным законом радиоактивного распада.
Формула (33.3) называется основным законом радиоактивного распада.
Число радиоактивных ядер убывает со временем по экспоненциальному закону.
На практике вместо постоянной распада λ часто используют другую величину, называемую периодом полураспада.
Период полураспада (Т) - время, в течение которого распадается половина радиоактивных ядер.
Закон радиоактивного распада с использованием периода полураспада записывается так:
График зависимости (33.4) показан на рис. 33.1.
Период полураспада может быть как очень большим, так и очень маленьким (от долей секунды до многих миллиардов лет). В табл. 33.1 представлены периоды полураспада для некоторых элементов.
 Рис. 33.1.
Убывание количества ядер исходного вещества при радиоактивном распаде
Рис. 33.1.
Убывание количества ядер исходного вещества при радиоактивном распаде
Таблица 33.1. Периоды полураспада для некоторых элементов
 Для оценки степени радиоактивности
изотопа используют специальную величину, называемую активностью.
Для оценки степени радиоактивности
изотопа используют специальную величину, называемую активностью.
Активность - число ядер радиоактивного препарата, распадающихся за единицу времени:
Единица измерения активности в СИ - беккерель (Бк), 1 Бк соответствует одному акту распада в секунду. На практике более упот-
ребительна внесистемная единица активности - кюри (Ки), равная активности 1 г 226 Ra: 1 Ки = 3,7х10 10 Бк.
С течением времени активность убывает так же, как убывает количество нераспавшихся ядер:
 33.2. Основные виды радиоактивного распада
33.2. Основные виды радиоактивного распада
В процессе изучения явления радиоактивности были обнаружены 3 вида лучей, испускаемых радиоактивными ядрами, которые получили названия α-, β- и γ-лучей. Позже было установлено, что α- и β-частицы - продукты двух различных видов радиоактивного распада, а γ-лучи являются побочным продуктом этих процессов. Кроме того, γ-лучи сопровождают и более сложные ядерные превращения, которые здесь не рассматриваются.
Альфа-распад состоит в самопроизвольном превращении ядер с испусканием α-частиц (ядра гелия).
Схема α-распада записывается в виде
 где Х, Y - символы материнского и дочернего ядер соответственно. При записи α-распада вместо «α« можно писать «Не».
где Х, Y - символы материнского и дочернего ядер соответственно. При записи α-распада вместо «α« можно писать «Не».
При этом распаде порядковый номер Z элемента уменьшается на 2, а массовое число А - на 4.
При α-распаде дочернее ядро, как правило, образуется в возбужденном состоянии и при переходе в основное состояние испускает γ-квант. Общее свойство сложных микрообъектов заключается в том, что они обладают дискретным набором энергетических состояний. Это относится и к ядрам. Поэтому γ-излучение возбужденных ядер обладает дискретным спектром. Следовательно, и энергетический спектр α-частиц является дискретным.
Энергия испускаемых α-частиц практически для всех α-активных изотопов лежит в пределах 4-9 МэВ.
Бета-распад состоит в самопроизвольном превращении ядер с испусканием электронов (или позитронов).
Установлено, что β-распад всегда сопровождается испусканием нейтральной частицы - нейтрино (или антинейтрино). Эта частица практически не взаимодействует с веществом, и в дальнейшем рассматриваться не будет. Энергия, выделяющаяся при β-распаде, распределяется между β-частицей и нейтрино случайным образом. Поэтому энергетический спектр β-излучения сплошной (рис. 33.2).
 Рис. 33.2.
Энергетический спектр β-распада
Рис. 33.2.
Энергетический спектр β-распада
Существует два вида β-распада.
1. Электронный β - -распад заключается в превращении одного ядерного нейтрона в протон и электрон. При этом появляется еще одна частица ν" - антинейтрино:
 Электрон и антинейтрино вылетают из ядра. Схема электронного β - -распада записывается в виде
Электрон и антинейтрино вылетают из ядра. Схема электронного β - -распада записывается в виде
 При электронном β-распаде порядковый номер Z-элемента увеличивается на 1, массовое число А не изменяется.
При электронном β-распаде порядковый номер Z-элемента увеличивается на 1, массовое число А не изменяется.
Энергия β-частиц лежит в диапазоне 0,002-2,3 МэВ.
2. Позитронный β + -распад заключается в превращении одного ядерного протона в нейтрон и позитрон. При этом появляется еще одна частица ν - нейтрино:
 Сам электронный захват не порождает ионизирующих частиц, но он сопровождается рентгеновским излучением.
Это
излучение возникает, когда место, освободившееся при поглощении
внутреннего электрона, заполняется электроном с внешней орбиты.
Сам электронный захват не порождает ионизирующих частиц, но он сопровождается рентгеновским излучением.
Это
излучение возникает, когда место, освободившееся при поглощении
внутреннего электрона, заполняется электроном с внешней орбиты.
Гамма-излучение имеет электромагнитную природу и представляет собой фотоны с длиной волны λ ≤ 10 -10 м.
Гамма-излучение не является самостоятельным видом радиоактивного распада. Излучение этого типа почти всегда сопровождает не только α-распад и β-распад, но и более сложные ядерные реакции. Оно не отклоняется электрическим и магнитным полями, обладает относительно слабой ионизирующей и очень большой проникающей способностями.
33.3. Количественные характеристики взаимодействия ионизирующего излучения с веществом
Воздействие радиоактивного излучения на живые организмы связано с ионизацией, которую оно вызывает в тканях. Способность частицы к ионизации зависит как от ее вида, так и от ее энергии. По мере продвижения частицы в глубь вещества она теряет свою энергию. Этот процесс называют ионизационным торможением.
Для количественной характеристики взаимодействия заряженной частицы с веществом используется несколько величин:
 После того как энергия частицы станет ниже энергии ионизации, ее ионизирующее действие прекращается.
После того как энергия частицы станет ниже энергии ионизации, ее ионизирующее действие прекращается.
Средний линейный пробег (R) заряженной ионизирующей частицы - путь, пройденный ею в веществе до потери ионизирующей способности.
Рассмотрим некоторые характерные особенности взаимодействия различных видов излучения с веществом.
Альфа-излучение
Альфа-частица практически не отклоняется от первоначального направления своего движения, так как ее масса во много раз больше
 Рис. 33.3.
Зависимость линейной плотности ионизации от пути, пройденного α-частицей в среде
Рис. 33.3.
Зависимость линейной плотности ионизации от пути, пройденного α-частицей в среде
массы электрона, с которым она взаимодействует. По мере ее проникновения в глубь вещества плотность ионизации сначала возрастает, а при завершении пробега (х = R) резко спадает до нуля (рис. 33.3). Это объясняется тем, что при уменьшении скорости движения возрастает время, которое она проводит вблизи молекулы (атома) среды. Вероятность ионизации при этом увеличивается. После того как энергия α-частицы станет сравнимой с энергией молекулярно-теплового движения, она захватывает два электрона в веществе и превращается в атом гелия.
Электроны, образовавшиеся в процессе ионизации, как правило, уходят в сторону от трека α-частицы и вызывают вторичную ионизацию.
Характеристики взаимодействия α-частиц с водой и мягкими тканями представлены в табл. 33.2.
Таблица 33.2. Зависимость характеристик взаимодействия с веществом от энергии α-частиц
 Бета-излучение
Бета-излучение
Для движения β -частицы в веществе характерна криволинейная непредсказуемая траектория. Это связано с равенством масс взаимодействующих частиц.
Характеристики взаимодействия β -частиц с водой и мягкими тканями представлены в табл. 33.3.
Таблица 33.3. Зависимость характеристик взаимодействия с веществом от энергии β-частиц
 Как и у α-частиц, ионизационная способность β-частиц растет при уменьшении энергии.
Как и у α-частиц, ионизационная способность β-частиц растет при уменьшении энергии.
Гамма-излучение
Поглощение γ -излучения веществом подчиняется экспоненциальному закону, аналогичному закону поглощения рентгеновского излучения:
Основными процессами, отвечающими за поглощение γ -излучения, являются фотоэффект и комптоновское рассеяние. При этом образуется относительно небольшое количество свободных электронов (первичная ионизация), которые обладают очень высокой энергией. Они-то и вызывают процессы вторичной ионизации, которая несравненно выше первичной.
33.4. Естественная и искусственная
радиоактивность. Радиоактивные ряды
Термины естественная и искусственная радиоактивность являются условными.
Естественной называют радиоактивность изотопов, существующих в природе, или радиоактивность изотопов, образующихся в результате природных процессов.
Например, естественной является радиоактивность урана. Естественной является и радиоактивность углерода 14 С, который образуется в верхних слоях атмосферы под действием солнечного излучения.
Искусственной называют радиоактивность изотопов, которые возникают в результате деятельности человека.
Таковой является радиоактивность всех изотопов, получаемых на ускорителях частиц. Сюда же можно отнести и радиоактивность почвы, воды и воздуха, возникающую при атомном взрыве.
Естественная радиоактивность
В начальный период изучения радиоактивности исследователи могли использовать лишь естественные радионуклиды (радиоактивные изотопы), содержащиеся в земных породах в достаточно большом количестве: 232 Th, 235 U, 238 U. С этих радионуклидов начинаются три радиоактивных ряда, заканчивающиеся стабильными изотопами РЬ. В дальнейшем был обнаружен ряд, начинающийся с 237 Np, с конечным стабильным ядром 209 Bi. На рис. 33.4 показан ряд, начинающийся с 238 U.
 Рис. 33.4.
Уран-радиевый ряд
Рис. 33.4.
Уран-радиевый ряд
Элементы этого ряда являются основным источником внутреннего облучения человека. Например, 210 Pb и 210 Po поступают в организм вместе с пищей - они концентрируются в рыбе и моллюсках. Оба этих изотопа накапливаются в лишайниках и поэтому присутствуют в мясе северного оленя. Наиболее весомым из всех естественных источников радиации является 222 Rn - тяжелый инертный газ, получающийся при распаде 226 Ra. На него приходится около половины дозы естественной радиации, получаемой человеком. Образуясь в земной коре, этот газ просачивается в атмосферу и попадает в воду (он хорошо растворим).
В земной коре постоянно присутствует радиоактивный изотоп калия 40 К, который входит в состав природного калия (0,0119 %). Из почвы этот элемент поступает через корневую систему растений и с растительной пищей (зерновые, свежие овощи и фрукты, грибы) - в организм.
Еще одним источником естественной радиации является космическое излучение (15 %). Его интенсивность возрастает в горных районах вследствие уменьшения защитного действия атмосферы. Источники природного радиационного фона указаны в табл. 33.4.
Таблица 33.4. Составляющая природного радиоактивного фона
 33.5. Использование радионуклидов в медицине
33.5. Использование радионуклидов в медицине
Радионуклидами называют радиоактивные изотопы химических элементов с малым периодом полураспада. В природе такие изотопы отсутствуют, поэтому их получают искусственно. В современной медицине радионуклиды широко используются в диагностических и терапевтических целях.
Диагностическое применение основано на избирательном накоплении некоторых химических элементов отдельными органами. Йод, например, концентрируется в щитовидной железе, а кальций - в костях.
Введение в организм радиоизотопов этих элементов позволяет обнаруживать области их концентрации по радиоактивному излучению и получать таким образом важную диагностическую информацию. Такой метод диагностики называется методом меченых атомов.
Терапевтическое использование радионуклидов основано на разрушающем действии ионизирующего излучения на клетки опухолей.
1. Гамма-терапия - использование γ-излучения высокой энергии (источник 60 Со) для разрушения глубоко расположенных опухолей. Чтобы поверхностно расположенные ткани и органы не подвергались губительному действию, воздействие ионизирующего излучения осуществляется в разные сеансы по разным направлениям.
2. Альфа-терапия - лечебное использование α-частиц. Эти частицы обладают значительной линейной плотностью ионизации и поглощаются даже небольшим слоем воздуха. Поэтому терапевтическое
применение альфа-лучей возможно при непосредственном контакте с поверхностью органа или при введении внутрь (с помощью иглы). Для поверхностного воздействия применяется радоновая терапия (222 Rn): воздействие на кожу (ванны), органы пищеварения (питье), органы дыхания (ингаляции).
В некоторых случаях лечебное применение α -частиц связано с использованием потока нейтронов. При этом методе в ткань (опухоль) предварительно вводят элементы, ядра которых под действием нейтронов испускают α -частицы. После этого больной орган облучают потоком нейтронов. Таким способом α -частицы образуются непосредственно внутри органа, на который они должны оказать разрушительное воздействие.
В таблице 33.5 указаны характеристики некоторых радионуклидов, используемых в медицине.
Таблица 33.5. Характеристика изотопов
 33.6. Ускорители заряженных частиц и их использование в медицине
33.6. Ускорители заряженных частиц и их использование в медицине
Ускоритель - установка, в которой под действием электрических и магнитных полей получаются направленные пучки заряженных частиц с высокой энергией (от сотен кэВ до сотен ГэВ).
Ускорители создают узкие пучки частиц с заданной энергией и малым поперечным сечением. Это позволяет оказывать направленное воздействие на облучаемые объекты.
Использование ускорителей в медицине
Ускорители электронов и протонов применяются в медицине для лучевой терапии и диагностики. При этом используются как сами ускоренные частицы, так и сопутствующее рентгеновское излучение.
Тормозное рентгеновское излучение получают, направляя пучок частиц на специальную мишень, которая и является источником рентгеновских лучей. От рентгеновской трубки это излучение отличается значительно большей энергией квантов.
Синхротронное рентгеновское излучение возникает в процессе ускорения электронов на кольцевых ускорителях - синхротронах. Такое излучение обладает высокой степенью направленности.
Прямое действие быстрых частиц связано с их высокой проникающей способностью. Такие частицы проходят поверхностные ткани, не вызывая серьезных повреждений, и оказывают ионизирующее действие в конце своего пути. Подбором соответствующей энергии частиц можно добиться разрушения опухолей на заданной глубине.
Области применения ускорителей в медицине показаны в табл. 33.6.
Таблица 33.6. Применение ускорителей в терапии и диагностике
 33.7. Биофизические основы действия ионизирующего излучения
33.7. Биофизические основы действия ионизирующего излучения
Как уже отмечалось выше, воздействие радиоактивного излучения на биологические системы связано с ионизацией молекул. Процесс взаимодействия излучения с клетками можно разделить на три последовательных этапа (стадии).
1. Физическая стадия состоит в передаче энергии излучения молекулам биологической системы, в результате чего происходит их ионизация и возбуждение. Длительность этой стадии 10 -16 -10 -13 с.
2. Физико-химическая стадия состоит из различного рода реакций, приводящих к перераспределению избыточной энергии возбужденных молекул и ионов. В результате появляются высокоактивные
продукты: радикалы и новые ионы с широким спектром химических свойств.
Длительность этой стадии 10 -13 -10 -10 с.
3. Химическая стадия - это взаимодействие радикалов и ионов между собой и с окружающими молекулами. На этой стадии формируются структурные повреждения различного типа, приводящие к изменению биологических свойств: нарушаются структура и функции мембран; возникают поражения в молекулах ДНК и РНК.
Длительность химической стадии 10 -6 -10 -3 с.
4. Биологическая стадия. На этой стадии повреждения молекул и субклеточных структур приводят к разнообразным функциональным нарушениям, к преждевременной гибели клетки в результате действия механизмов апоптоза или вследствие некроза. Повреждения, полученные на биологической стадии, могут передаваться по наследству.
Продолжительность биологической стадии от нескольких минут до десятков лет.
Отметим общие закономерности биологической стадии:
Большие нарушения при малой поглощенной энергии (смертельная для человека доза облучения вызывает нагрев тела всего на 0,001°С);
Действие на последующие поколения через наследственный аппарат клетки;
Характерен скрытый, латентный период;
Разные части клеток обладают различной чувствительностью к излучению;
Прежде всего поражаются делящиеся клетки, что особенно опасно для детского организма;
Губительное действие на ткани взрослого организма, в которых есть деление;
Сходство лучевых изменений с процессами патологии раннего старения.
33.8. Основные понятия и формулы
 Продолжение таблицы
Продолжение таблицы
 33.9. Задачи
33.9. Задачи
1. Какова активность препарата, если в течение 10 мин распадается 10 000 ядер этого вещества?
 4.
Возраст древних образцов дерева можно приближенно определить по удельной массовой активности изотопа 14 6 C
в них. Сколько лет тому назад было срублено дерево, которое пошло на
изготовление предмета, если удельная массовая активность углерода в нем
составляет 75 % от удельной массы активности растущего дерева? Период
полураспада радона Т = 5570 лет.
4.
Возраст древних образцов дерева можно приближенно определить по удельной массовой активности изотопа 14 6 C
в них. Сколько лет тому назад было срублено дерево, которое пошло на
изготовление предмета, если удельная массовая активность углерода в нем
составляет 75 % от удельной массы активности растущего дерева? Период
полураспада радона Т = 5570 лет.
 9.
После Чернобыльской аварии в некоторых местах загрязненность почвы радиоактивным цезием-137 была на уровне 45 Ки/км 2 .
9.
После Чернобыльской аварии в некоторых местах загрязненность почвы радиоактивным цезием-137 была на уровне 45 Ки/км 2 .
Через сколько лет активность в этих местах снизится до относительно безопасного уровня 5 Ки/км 2 . Период полураспада цезия-137 равен Т = 30 лет.
 10.
Допустимая
активность йода-131 в щитовидной железе человека должна быть не более 5
нКи. У некоторых людей, находившихся в зоне Чернобыльской катастрофы,
активность йода-131 доходила до 800 нКи. Через сколько дней активность
снижалась до нормы? Период полураспада йода-131 равен 8 суткам.
10.
Допустимая
активность йода-131 в щитовидной железе человека должна быть не более 5
нКи. У некоторых людей, находившихся в зоне Чернобыльской катастрофы,
активность йода-131 доходила до 800 нКи. Через сколько дней активность
снижалась до нормы? Период полураспада йода-131 равен 8 суткам.
 11.
Для
определения объема крови у животного используется следующий метод. У
животного берут небольшой объем крови, отделяют эритроциты от плазмы и
помещают их в раствор с радиоактивным фосфором, который ассимилируется
эритроцитами. Меченые эритроциты снова вводят в кровеносную систему
животного, и через некоторое время определяют активность пробы крови.
11.
Для
определения объема крови у животного используется следующий метод. У
животного берут небольшой объем крови, отделяют эритроциты от плазмы и
помещают их в раствор с радиоактивным фосфором, который ассимилируется
эритроцитами. Меченые эритроциты снова вводят в кровеносную систему
животного, и через некоторое время определяют активность пробы крови.
В кровь некоторого животного ввели ΔV = 1 мл такого раствора. Начальная активность этого объема была равна А 0 = 7000 Бк. Активность 1 мл крови, взятой из вены животного через сутки, оказалась равной 38 импульсов в минуту. Определить объем крови животного, если период полураспада радиоактивного фосфора равен Т = 14,3 суток.
Лекция 2. Основной закон радиоактивного распада и активность радионуклидов
Скорость распада радионуклидов различна – одни распадаются быстрее, другие – медленнее. Показателем скорости радиоактивного распада является постоянная радиоактивного распада, λ [сек -1], которая характеризует вероятность распада одного атома за одну секунду. Для каждого радионуклида постоянная распада имеет своё значение, чем оно больше, тем быстрее распадаются ядра вещества.
Число распадов, регистрируемых в радиоактивном образце за единицу времени, называют активностью (a ), или радиоактивностью образца. Значение активности прямо пропорционально количеству атомов N радиоактивного вещества:
a =λ· N , (3.2.1)
где λ – постоянная радиоактивного распада, [сек-1].
В настоящее время, согласно действующей Международной системе единиц СИ, за единицу измерения радиоактивности принят беккерель [Бк ]. Своё название эта единица получила в честь французского учёного Анри Беккереля, открывшего в 1856 г. явление естественной радиоактивности урана. Один беккерель равен одному распаду в секунду 1 Бк = 1 .
Однако до сих пор достаточно часто применяется внесистемная единица активности – кюри [Ки ], введённая супругами Кюри как мера скорости распада одного грамма радия (в котором происходит ~3,7·1010 распадов в секунду), поэтому
1 Ки = 3,7·1010 Бк .
Эта единица удобна для оценки активности больших количеств радионуклидов.
Снижение концентрации радионуклида во времени в результате распада подчиняется экспоненциальной зависимости:
 , (3.2.2)
, (3.2.2)
где N t – количество атомов радиоактивного элемента оставшихся через время t после начала наблюдения; N 0 – количество атомов в начальный момент времени (t =0 ); λ – постоянная радиоактивного распада.
Описанная зависимость называется основным законом радиоактивного распада .
Время, за которое распадается половина от общего количества радионуклидов, называется периодом полураспада, Т ½ . Через один период полураспада из 100 атомов радионуклида остаются только 50 (рис. 2.1). За следующий такой же период из этих 50 атомов остаются лишь 25 и так далее.
Связь между периодом полураспада и постоянной распада выводится из уравнения основного закона радиоактивного распада:
при t =T ½ и
получаем https://pandia.ru/text/80/150/images/image006_47.gif" width="67" height="41 src="> Þ ;
https://pandia.ru/text/80/150/images/image009_37.gif" width="76" height="21">;
т. е..gif" width="81" height="41 src=">.
Поэтому закон радиоактивного распада можно записать следующим образом:
https://pandia.ru/text/80/150/images/image013_21.gif" width="89" height="39 src=">, (3.2.4)
где at – активность препарата через время t ; a 0 – активность препарата в начальный момент наблюдения.
Часто необходимо определить активность заданного количества любого радиоактивного вещества.
Вспомним, что единица количества вещества – моль. Моль – это количество вещества, содержащее столько же атомов, сколько их содержится в 0,012 кг=12 г изотопа углерода 12С.
В одном моле любого вещества содержится число Авогадро NA атомов:
NA = 6,02·1023 атомов.
Для простых веществ (элементов) масса одного моля численно соответствует атомной массе А элемента
1моль = А г.
Например: Для магния: 1 моль 24Mg = 24 г.
Для 226Ra: 1 моль 226Ra = 226 г и т. д.
С учётом сказанного в m граммах вещества будет N атомов:
https://pandia.ru/text/80/150/images/image015_20.gif" width="156" height="43 src="> (3.2.6)
Пример: Подсчитаем активность 1-го грамма 226Ra, у которого λ = 1.38·10-11 сек-1.
a = 1.38·10-11·1/226·6,02·1023 = 3,66·1010 Бк.
Если радиоактивный элемент входит в состав химического соединения, то при определении активности препарата необходимо учитывать его формулу. С учётом состава вещества определяется массовая доля χ радионуклида в веществе, которая определяется соотношением:
https://pandia.ru/text/80/150/images/image017_17.gif" width="118" height="41 src=">
Пример решения задачи
Условие:
Активность А0 радиоактивного элемента 32Р в день наблюдения составляет 1000 Бк . Определить активность и количество атомов этого элемента через неделю. Период полураспада Т ½ 32Р = 14,3 дня.
Решение:
а) Найдём активность фосфора-32 через 7 суток:
https://pandia.ru/text/80/150/images/image019_16.gif" width="57" height="41 src=">
Ответ: через неделю активность препарата 32Р составит 712 Бк, а количество атомов радиоактивного изотопа 32Р – 127,14·106 атомов.
Контрольные вопросы
1) Что такое активность радионуклида?
2) Назовите единицы радиоактивности и связь между ними.
3) Что такое постоянная радиоактивного распада?
4) Дайте определение основному закону радиоактивного распада.
5) Что такое период полураспада?
6) Какая существует связь между активностью и массой радионуклида? Напишите формулу.
Задачи
1. Рассчитайте активность 1 г 226Ra. Т½ = 1602 года.
2. Рассчитайте активность 1 г 60Со. Т½ = 5,3 года.
3. Один танковый снаряд М-47 содержит 4,3 кг 238U. Т½ = 2,5·109 лет. Определите активность снаряда.
4. Рассчитайте активность 137Cs через 10 лет, если в начальный момент наблюдения она равна 1000 Бк . Т½ = 30 лет.
5. Рассчитайте активность 90Sr год назад, если в настоящий момент времени она равна 500 Бк . Т½ = 29 лет.
6. Какую активность будет создавать 1 кг радиоизотопа 131I, Т½ = 8,1 дня?
7. Пользуясь справочными данными, определите активность 1 г 238U. Т½ = 2,5·109 лет.
Пользуясь справочными данными, определите активность 1 г 232Th, Т½ = 1,4·1010 лет.
8. Рассчитайте активность соединения: 239Pu316O8.
9. Вычислите массу радионуклида активностью в 1 Ки :
9.1. 131I, Т1/2=8,1 дня;
9.2. 90Sr, Т1/2=29 лет;
9.3. 137Cs, Т1/2=30 лет;
9.4. 239Pu, Т1/2=2,4·104 лет.
10. Определите массу 1 мКи радиоактивного изотопа углерода 14С, Т½ = 5560 лет.
11. Необходимо приготовить радиоактивный препарат фосфора 32P. Через какой промежуток времени останется 3 % препарата? Т½ = 14,29 сут.
12. В природной смеси калия содержится 0,012 % радиоактивного изотопа 40К.
1) Определите массу природного калия, в котором содержится 1 Ки 40К. Т½ = 1,39·109 лет = 4,4·1018 сек.
2) Рассчитайте радиоактивность грунта по 40К, если известно, что содержание калия в образце грунта – 14 кг/т.
13. Сколько периодов полураспада требуется для того, чтобы первоначальная активность радиоизотопа снизилась до 0,001 %?
14. Для определения влияния 238U на растения семена замачивали в 100 мл раствора UO2(NO3)2·6H2O, в котором масса радиоактивной соли составляла 6 г . Определите активность и удельную активность 238U в растворе. Т½ = 4,5·109 лет .
15. Определите активность 1 грамма 232Th, Т½ = 1,4·1010 лет.
16. Определите массу 1 Ки 137Cs, Т1/2=30 лет.
17. Соотношение между содержанием стабильных и радиоактивного изотопов калия в природе – величина постоянная. Содержание 40К равно 0,01%. Рассчитайте радиоактивность грунта по 40К, если известно, что содержание калия в образце грунта – 14 кг/т .
18. Литогенная радиоактивность окружающей среды формируется преимущественно за счёт трёх основных природных радионуклидов: 40К, 238U, 232Th. Доля радиоактивных изотопов в природной сумме изотопов составляет 0,01, 99,3, ~100 соответственно. Рассчитайте радиоактивность 1 т грунта, если известно, что относительное содержание калия в образце грунта 13600 г/т , урана – 1·10-4 г/т , тория – 6·10-4 г/т.
19. В раковинах двустворчатых моллюсков обнаружено 23200 Бк/кг 90Sr. Определите активность образцов через 10, 30, 50, 100 лет.
20. Основное загрязнение замкнутых водоёмов Чернобыльской зоны состоялось в первый год после аварии на АЭС . В донных отложениях оз. Азбучин в 1999 г. обнаружен 137Cs с удельной активностью 1,1·10 Бк/м2 . Определите концентрацию (активность) выпавшего 137Cs на м2 донных отложений по состоянию на 1986-1987гг. (12 лет назад).
21. 241Am (Т½ = 4,32·102 лет) образуется из 241Pu (Т½ = 14,4 лет) и является активным геохимическим мигрантом. Пользуясь справочными материалами, рассчитайте с точностью до 1% уменьшение активности плутония-241 во времени, в каком году после Чернобыльской катастрофы образование 241Am в окружающей среде будет максимальным.
22. Рассчитайте активность 241Am в продуктах выбросах Чернобыльского реактора по состоянию на апрель
2015 г., при условии, что в апреле 1986 г. активность 241Am составила 3,82·1012 Бк,
Т½ = 4,32·102 лет.
23. В образцах грунта обнаружено 390 нКи/кг 137Cs. Рассчитайте активность образцов через 10, 30, 50, 100 лет.
24. Средняя концентрация загрязнения ложа оз. Глубокого, расположенного в Чернобыльской зоне отчуждения, составляет 6,3·104 Бк 241Am и 7,4·104 238+239+240Pu на 1 м2. Рассчитайте, в каком году получены эти данные.
Радиоактивный распад атомных ядер происходит самопроизвольно и приводит к непрерывному уменьшению числа атомов исходного радиоактивного изотопа и накоплению атомов продукта распада.
Скорость, с которой распадаются радионуклиды, определяется только степенью нестабильности их ядер и не зависит от любых факторов, обычно влияющих на скорость физических и химических процессов (давления, температуры, химической формы вещества и др.). Распад каждого отдельного атома - событие совершенно случайное, вероятностное и независимое от поведения других ядер. Однако при наличии в системе достаточно большого числа радиоактивных атомов проявляется общая закономерность, состоящая в том, что количество атомов данного радиоактивного изотопа, распадающихся в единицу времени, всегда составляет определенную, характерную для данного изотопа долю от полного числа еще не распавшихся атомов. Число атомов ДУУ, претерпевших распад за малый промежуток времени Д/, пропорционально общему числу нераспавшихся радиоактивных атомов УУ и величине интервала ДЛ Этот закон математически может быть представлен в виде соотношения:
-AN = X ? N ? Д/.
Знак минус указывает, что число радиоактивных атомов N убывает. Коэффициент пропорциональности X носит название постоянной распада и является константой, характерной для данного радиоактивного изотопа. Закон радиоактивного распада обычно записывают в виде дифференциального уравнения:
Итак, закон радиоактивного распада может быть сформулирован следующим образом: за единицу времени распадается всегда одна и та же часть имеющихся в наличии ядер радиоактивного вещества.
Постоянная распада X имеет размерность обратного времени (1/с или с -1). Чем больше X, тем быстрее происходит распад радиоактивных атомов, т.е. X характеризует относительную скорость распада для каждого радиоактивного изотопа или вероятность распада атомного ядра в 1 с. Постоянная распада - это доля атомов, распадающихся в единицу времени, показатель нестабильности радионуклида.
Величина-- абсолютная скорость радиоактивного распада -
называется активностью. Активность радионуклида (А) - это количество распадов атомов, происходящих в единицу времени. Она зависит от количества радиоактивных атомов в данный момент времени (И) и от степени их нестабильности:
А=Ы ( X.
Единицей измерения активности в СИ является беккерель (Бк); 1 Бк - активность, при которой происходит одно ядерное превращение в секунду, независимо от типа распада. Иногда используется внесистемная единица измерения активности - кюри (Ки): 1Ки = = 3,7-10 10 Бк (количество распадов атомов в 1 г 226 Яа за 1 с).
Поскольку активность зависит от числа радиоактивных атомов, то эта величина служит количественной мерой содержания радионуклидов в изучаемом образце.
На практике удобнее пользоваться интегральной формой закона радиоактивного распада, которая имеет следующий вид:
где УУ 0 - число радиоактивных атомов в начальный момент времени / = 0; - число радиоактивных атомов, оставшихся к моменту
времени /; X - постоянная распада.
Для характеристики радиоактивного распада часто вместо постоянной распада X используют другую величин, производную от нее - период полураспада. Период полураспада (Т ]/2) - это промежуток времени, в течение которого распадается половина начального количества радиоактивных атомов.
Подставляя в закон радиоактивного распада значения Г = Т 1/2 и И ( = Аф/2, получаем:
УУ 0 /2 = # 0 е~ хт ог-
1 /2 = е~ хт "/ 2 -, а е хт "/ 2 = 2 или ХТ 1/2 = 1п2.
Период полураспада и постоянная распада связаны следующим соотношением:
Т х/2 =1п2 А = 0,693 /X.
Используя эту зависимость, закон радиоактивного распада можно представить в другом виде:
ТУ, = УУ 0 е Апг, " т т
N = И 0 ? е-°’ т - { / т 02.
Из этой формулы следует, что чем больше период полураспада, тем медленнее происходит радиоактивный распад. Периоды полураспада характеризуют степень стабильности радиоактивного ядра и для разных изотопов меняются в широких пределах - от долей секунды до миллиардов лет (см. приложения). В зависимости от периода полураспада радионуклиды условно делятся на долгоживущие и короткоживущие.
Период полураспада, наряду с типом распада и энергией излучения, является важнейшей характеристикой любого радионуклида.
На рис. 3.12 изображена кривая распада радиоактивного изотопа. По горизонтальной оси отложено время (в периодах полураспада), а по вертикальной оси - число радиоактивных атомов (или активность, так как она пропорциональна количеству радиоактивных атомов).
Кривая является экспонентой и асимптотически приближается к оси времени, никогда не пересекая ее. Через промежуток времени, равный одному периоду полураспада (Г 1/2) количество радиоактивных атомов уменьшается в 2 раза, через два периода полураспада (2Г 1/2) количество оставшихся атомов вновь уменьшается в два раза, т.е. в 4 раза от начального их числа, через 3 7" 1/2 - в 8 раз, через
4Г 1/2 - в 16 раз, через т периодов полураспада Г ]/2 - в 2 т раз.
Теоретически совокупность атомов с нестабильными ядрами будет уменьшаться до бесконечности. Однако с практической точки зрения следует обозначить некий предел, когда условно все радиоактивные нуклиды распались. Считается, что для этого необходим отрезок времени протяженностью 107^ , 2 , по истечении которого от исходного количества останется менее 0,1 % радиоактивных атомов. Таким образом, если принимать во внимание только физический распад, для полного очищения биосферы от 90 Бг (= 29 лет) и |37 Сз (Т|/ 2 = 30 лет) чернобыльского происхождения потребуется соответственно 290 и 300 лет.
Радиоактивное равновесие. Если при распаде радиоактивного изотопа (материнского) образуется новый радиоактивный изотоп (дочерний), то говорят, что они генетически связаны между собой и образуют радиоактивное семейство (ряд).
Рассмотрим случай генетически связанных радионуклидов, из которых материнский - долгоживущий, а дочерний - короткожи-вущий. Примером может служить стронций 90 5г, превращающийся путем (3-распада (Т /2 = 64 ч) и превращается в стабильный нуклид цирконий ^Ъх (см. рис. 3.7). Поскольку 90 У распадается намного быстрее, чем 90 5г, то через некоторое время наступит момент, когда количество распадающегося 90 8г в любой момент будет равно количеству распадающегося 90 У. Другими словами, активность материнского 90 8г (Д,) будет равна активности дочернего 90 У (Л 2). Когда это происходит, считается, что 90 У находится в вековом равновесии с его материнским радионуклидом 90 8г. В этом случае выполняется соотношение:
А 1 =Л 2 или Х 1 ? = Х 2 ? УУ 2 или: Г 1/2(1) = УУ 2: Г 1/2(2) .
Из приведенного выше соотношения вытекает, что чем больше вероятность распада радионуклида (к) и, соответственно, меньше период полураспада (Т ]/2), тем меньше содержится его атомов в смеси двух изотопов (АО-
Для установления такого равновесия требуется время, равное примерно 7Т ]/2 дочернего радионуклида. В условиях векового равновесия суммарная активность смеси нуклидов вдвое больше активности материнского нуклида в данный момент времени. Например, если в начальный момент времени препарат содержит только 90 8г, то спустя 7Т /2 самого долгоживущего члена семейства (кроме родоначальника ряда), устанавливается вековое равновесие, и скорости распада всех членов радиоактивного семейства становятся одинаковыми. Учитывая, что периоды полураспада для каждого члена семейства различны, различны и относительные количества (в том числе и массовые) находящихся в равновесии нуклидов. Чем меньше Т }














